คุณสมบัติทางเทอร์โมไดนามิคส์ (Thermodynamic properties)
เปิดอ่าน 19,353
สิ่งสำคัญในการวิเคราะห์ระบบทางความร้อน คือ การให้นิยามแก่คุณสมบัติทางเทอร์โมไดนามิคส์ โดย ขอบเขต (boundary) จะหมายถึงลักษณะเฉพาะตัวของวัตถุ หรือสารที่สามารถวัดหาขนาดออกมาได้ เช่น อุณหภูมิ ความดัน และความหนาแน่น ถือเป็นคุณสมบัติ ส่วนงาน และการถ่ายเทความร้อนนั้น เราสามารถวัดออกมาได้ในรูปของการเปลี่ยนแปลงคุณสมบัติ แต่โดยตัวมันเองไม่ใช่คุณสมบัติ หรือกล่าวอีกนัยหนึ่ง คุณสมบัติสิ่งที่สาร “มี” อยู่ในตัวขณะที่งานและการถ่ายเทความร้อนเป็นสิ่ง “กระทำ” กับระบบ จนเกิดการเปลี่ยนแปลงคุณสมบัติ เราสมารถวัดขนาดของงานและความร้อนได้จากขอบเขต (boundary ) ของระบบ และปริมาณของพลังงานที่ถ่ายเทจะมากหรือน้อยขึ้นอยู่กับการเปลี่ยนแปลงของคุณสมบัติว่าเป็นเช่นไร
เนื่องจากเทอร์โมไดนามิคส์มีศูนย์กลางอยู่ที่เรื่องพลังงาน คุณสมบัติทางเทอร์โมไดนามิคส์ทุกตัวจึงเกี่ยวพันอยู่กับพลังงาน และสภาวะ (state) ทางเทอร์โมไดนามิคส์ของระบบจะถูกระบุได้ด้วยค่าของคุณสมบัติ ในสภาพปกติทั่วไป เราสามารถระบุสภาวะของระบบได้ด้วยคุณสมบัติ 2 ตัวที่เป็นอิสระต่อกัน เช่น ไอน้าที่อุณหภูมิ 125 ความดันบรรยากาศ แต่ในสภาพที่ระบบมีมากกว่า 1 สถานะ เช่น อากาศแห้งและไอน้ำ การจะระบุสภาวะได้อาจจะต้องทราบคุณสมบัติถึง 3 ตัว ถ้าเราสามารถระบุสภาวะของสารหรือระบบได้แล้ว ก็จะสามารถทราบค่าของคุณสมบัติอื่น ๆ ที่ไม่ขึ้นต่อกันได้
คุณสมบัติเทอร์โมไดนามิคส์ที่เราสนใจจะกล่าวถึงในที่นี้ ได้แก่ อุณหภูมิ ความดัน ความหนาแน่น ปริมาตรจำเพาะ (specific volume) ความร้อนจำเพาะ (specific heat) เอนทัลปี (enthalpy) เอนโทรปี (entropy) และ คุณสมบัติสถานะของเหลวและไอ (liquid -vapor property of state)
อุณหภูมิ (Temperature: t)
อุณหภูมิของสารเป็นตัวบ่งชี้ถึงสภาวะทางความร้อน และความสามารถในการแลกเปลี่ยน พลังงานกับสารกับสารเมื่อนำมาสัมผัสด้วย โดยที่สารที่มีอุณหภูมิสูงกว่าจะส่งถ่ายพลังงานไปสู่สารที่มีอุณหภูมิต่ำกว่า ในหน่วย S.I. เราใช้องศาเซลเซียส (๐C) เป็นตัววัดอุณหภูมิ โดยมีระดับอ้างอิงที่จุดเยือกแข็งของน้ำ (0๐C) และจุดเดือดของน้ำ (100๐C)
อุณหภูมิสัมบูรณ์ ( Temperature: T)
เป็นตัวเลขบอกองศาที่อยู่เหนือจุดศูนย์สัมบูรณ์ (absolute zero) แสดงค่าด้วยเคลวิน (K) โดยที่ T = 1๐C + 273 ดังนั้น ความแตกต่างอุณหภูมิของทั้ง 2 สเกลนี้ จึงมีค่าเท่ากัน ซึ่งสามารถใช้แทนกันได้
ความดัน (Pressure: P)
เป็นแรงตั้งฉากที่ของไหลกระทำต่อ 1 หน่วยพื้นที่ ที่ต้านทิศทางแรงนั้น ความดันสมบูรณ์ เป็นการวัดความดันเหนือจุดศูนย์ ความดันเกจ เป็นการวัดความดันที่สูงกว่าความดันบรรยากาศ หน่วยที่ใช้ในการวัดความดันในระบบ คือ นิวตันต่อตารางเมตร (N/m2) หรือ เรียกว่า ปาสคาล (Pascal, Pa) นิวตัน เป็นหน่วยที่ใช้วัดแรง (N) ความดันบรรยากาศมาตรฐาน มีค่า = 101.3 kPa (14.7 psia) เครื่องมือที่ใช้วัดความดัน ได้แก่ pressure gauges และ manometer
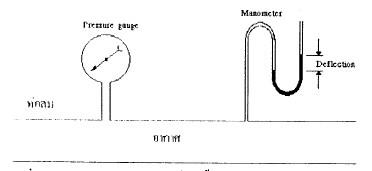
(ความดันเกจในท่อลมซึ่งติดตั้งมาตรวัดความดัน และมานอมิเตอร์)
ความหนาแนน่ และปริมาตรจำเพาะ (Density and specific volume: , v )
ความหนาแน่นของของไหล หาได้โดย นำมวลหารด้วยปริมาตร ในขณะที่ปริมาตรจำเพาะ หาได้โดยนำปริมาตรหารด้วยมวล ดังนั้น ความหนาแน่น และปริมาตรจำเพาะ จึงเป็นปฏิภาค กลับซึ่งกันและกัน ความหนาแน่นของอากาศที่ความดันบรรยากาศมาตรฐาน และ 25๐C มีค่าโดยประมาณ เท่ากับ 1.2 kg/m3
ความร้อนจำเพาะ (Specific heat: Cp)
ความร้อนจำเพาะของสาร หมายถึง ปริมาณของพลังงานที่ต้องการในการทำให้ 1 หน่วยมวลของตัวมันมีอุณหภูมิสูงขึ้น 1 หน่วยองศา (1 K) ความร้อนจำเพาะพื้นฐานที่ใช้กันมี 2 ตัว ความร้อนจำเพาะที่ปริมาตรคงที่ (Specific heat at content volume, Cv) และความร้อนจำเพาะที่ความดันคงที่ (Specific heat at content pressure, Cp) ซึ่งตัวหลังจะถูกกล่าวถึงมากกว่า เนื่องจากมันสามารถ นำไปใช้กับกระบวนการต่าง ๆ เป็นที่เกิดขึ้นในการทำความเย็น และการปรับอากาศ
เอนทัลปี (Enthalpy: h)
ถ้าในขบวนการความดันคงที่ดังตัวอย่างที่ 1.2 ไม่มีงานเกิดขึ้น ขนาดของความร้อนที่เพิ่ม หรือที่ขจัดออกต่อหน่วยมวล จะแทนการเปลี่ยนแปลงเอนทัลปีของสาร เราสามารถหาค่าเอนทัลปีของสารหลายตัวได้จากตาราง และแผนภูมิ (charts) ซึ่งค่า เอนทัลปี เหล่านี้ จะมีพื้นฐานอ้างอิงมาจาก
การเลือกระดับที่กำหนด (datum plane) ให้โดยไม่มีเกณฑ์ เช่น datum plane ของน้ำและไอน้ำนั้น เอนทัลปี จะมีค่าศูนย์ (0) สำหรับที่ 0๐C โดยพื้นฐานอ้างอิงตัวนี้ เอนทัลปี ของน้ำที่ 100๐C จะมีค่า 419.06 kJ/kg และไอน้ำที่ 100๐C จะมีค่า 2676 kJ/kg
เอนโทรปี (Entropy: s)
แม้ว่าว่าจะเป็นการยากมากในการนิยามคำว่า เอนโทรปี เนื่องจากมันต้องอาศัยคำอธิบายสำคัญหลายอย่างทั้งในด้านเทคนิค และปรัชญา แต่เราก็จะใช้คุณสมบัติตัวนี้ในการระบุ และกำหนดพฤติกรรมของสารเช่นกัน เราสามารถอ่านค่า เอนโทรปี ได้จากตารางหรือ แผนภูมิของคุณสมบัติ เช่นเดียวกับ เอนทัลปี ในที่นี้จะกล่าวถึงสมติฐานที่มีส่วนเกี่ยวพันกับคุณสมบัติตัวนี้ 2 ข้อ ด้วย กันคือ
1. ถ้าแก๊ส หรือ ไอ ถูกอัด (compressed) หรือขยายตัว (expanded) แบบไม่มีความเสียดทานโดยไม่มีการเพิ่มหรือขจัดความร้อนระหว่างขบวนการแล้ว ค่า เอนโทรปี ของสารจะถือว่าคงที่
2. ตามกระขบวนการในข้อ 1 การเปลี่ยนแปลงของเอนทัลปี ที่เกิดขึ้นจะแสดงปริมาณของงาน (work) ต่อหน่วยมวล ที่ต้องการให้การอัด หรือที่ได้ออกมาจากการขยายตัว เป็นไปได้ว่า การใช้งานเกี่ยวกับ เอ็นโทรปี ที่มากที่สุด ก็คือ การอ่านค่าตามเส้นเอนโทรปีคงที่ในกราฟ เพื่อคำนวณงานของการอัด ในระบบทำความเย็นแบบอัดไอ (Vapor-compression refrigeration cycles)
คุณสมบัติของของเหลว - ไอ (Liquid –vapor properties)
ระบบทางความร้อน ส่วนมากแล้ว สารที่ไหลเวียนในวัฏจักรจะเปลี่ยนสภาวะไปมาระหว่างสถานะที่เป็นของเหลว และไอ ความดัน อุณหภูมิ และ เอนทัลปี จะเป็นคุณสมบัติที่เป็นกุญแจสำคัญในการเปลี่ยนแปลงนี้ ความสัมพันธ์ระหว่างคุณสมบัติเหล่านี้ จะแสดงในตาราง หรือบนแผนภูมิต่าง ๆ เช่น แผนภูมิ ความดัน และ เอนทัลปีสำหรับน้ำ








 ร้านเชียงใหม่แอร์แคร์ • ขายส่งแอร์ แอร์มือหนึ่งราคาถูก แอร์มือสองสภาพดี จำหน่ายแอร์ชั้นนำทุกยี่ห้อ พร้อมบริการติดตั้งฟรีถึงที่ ด้วยช่างและวิศวกรผู้ชำนาญการ
ร้านเชียงใหม่แอร์แคร์ • ขายส่งแอร์ แอร์มือหนึ่งราคาถูก แอร์มือสองสภาพดี จำหน่ายแอร์ชั้นนำทุกยี่ห้อ พร้อมบริการติดตั้งฟรีถึงที่ ด้วยช่างและวิศวกรผู้ชำนาญการ